Salamanderpest / Batrachochytrium salamandrivorans (Bsal)
Der Hautpilz Batrachochytrium salamandrivorans (Bsal) verursacht Chytridiomykose, eine tödliche Hautkrankheit, bei Salamandern und Molchen. Bsal ist verwandt mit dem anderen Amphibien Hautpilz Batrachochytrium dendrobatidis (Bd), der der Wissenschaft erst seit 1997 bekannt ist. Bd und Bsal haben sich vor schätzungsweise 50 Millionen Jahren auseinander entwickelt (A. Martel et al. 2014 [1]). Bsal führt bei Schwanzlurchen zu Hautläsionen und Hautgeschwüren. Oftmals sind die 1 bis 2 mm großen Hautläsionen von einem scharzen Rand umgeben. Bei dem Feuersalamander sind diese schwarzen Ränder besonders gut zu erkennen (vgl. Abbildung 1 & 2), etwas weniger gut erkennbar sind sie beim Bergmolch (vgl. Abbildung 5). In einem späteren Verlauf kann es zu größeren Hautläsionen und Hautgeschwüren kommen (vgl. Abbildung 3 & 4).

© A. Martel & F. Pasmans (Ghent University)

© A. Martel & F. Pasmans (Ghent University)

© A. Martel & F. Pasmans (Ghent University)

© A. Martel & F. Pasmans (Ghent University)

© A. Martel & F. Pasmans (Ghent University)
Bsal Verdachtsfälle melden
Bsal Verdachtsfälle sollten umgehend gemeldet werden. Ansammlungen von toten Tieren sind immer zu melden. Je früher die Meldung erfolgt, desto besser sind die Chancen das Massnahmen lokal greifen. Die Kontakte für das Melden von Bsal Verdachtsfällen sind unter www.bsaleurope.com/report-cases/ für einige Länder aufgelistet.
Fotos und genaue Ortsangaben sind immer sehr nützlich für Wissenschaftler. Falls möglich können auch Abstriche mit Wattestäbchen oder tote Exemplare in Plastiksäcken eingesammelt werden. Die Exemplare sollten möglichst rasch eingefroren oder besser gekühlt und in Ethanol gegeben werden. Bei zu langem Warten schreitet der Verwesungsprozess zu stark voran und der Bsal Pilz kann nicht mehr nachgewiesen werden. Versuchen Sie möglichst wenig Dreck mitzunehmen und desinfizieren Sie wenn möglich ihre Schuhe, Utensilien, etc. Nehmen Sie Kontakt mit dem zuständigen Veterinäramt auf. Der Test für Wildtiere auf Parasiten sollte immer kostenlos sein. Die Proben können dann vorbeigebracht oder per Post zugestellt werden. Je nach dem betreffenden Land senden die Veterinärämter auch Personen, die die Proben abholen. Eine Übersicht der Bsal Diagnose Zentren resp. Veterinäramter gibt es hier.
Verbreitung
Bsal wurde erst 2013, nach der Entdeckung von massiven Einbrüchen von Feuersalamandern in den Niederlanden und Belgien, beschrieben. Bsal ist einheimisch in Südostasien und wurde wahrscheinlich mit dem Tierhandel nach Europa gebracht. Die Molche und Salamander aus Südostasien können ohne Probleme mit Bsal koexistieren. In Europa und Nordamerika kann Bsal aber grosse Schäden anrichten. In den Niederlanden ist der Feuersalamander wegen Bsal nahezu komplett ausgestorben. Bsal ist in der Natur Europas bereits in folgenden Ländern nachgewiesen worden: Niederlande, Belgien, Deutschland (Ruhrgebiet, Eifel, Bayern) und Spanien. Während der Chytridpilz Bsal in der Niederlande, Belgien und Deutschland v. a. durch tote Feuersalamander (Salamandra salamandra) bekannt wurde, führte er in Nordspanien bei einer Population von Marmormolchen (Triturus marmoratus) zu einem Massensterben. Furchterregend ist, dass die Fundstelle in Nordspanien 1000 km von der am nächst nachgewiesenen, natürlichen Aussbruchstelle liegt. Kürzlich (2020) wurde Bsal auch in Bayern festgestellt, wo der Hautpilz Feuersalamander und Bergmolche tötete. In Abbildung 6 sind die Fundorte von Bsal in der Natur eingetragen. In der Niederlande und Belgien sind nur wenige Fundorte eingetragen, obwohl Bsal dort weitflächiger gefunden werden kann als in den anderen Ländern.
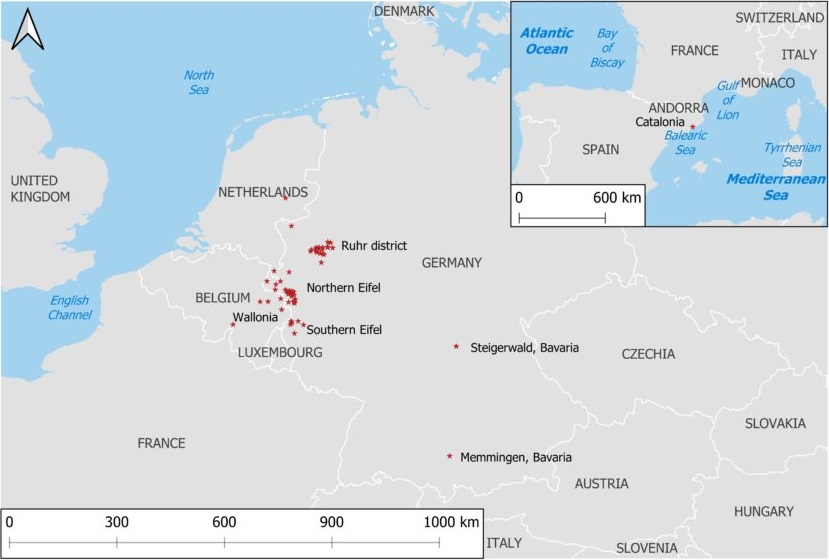
© http://bsaleurope.com/european-distribution/
Betroffene Arten
Die meisten Arten der Molche und Salamander von Europa und Nordamerika. Wobei nicht alle Arten gleich betroffen sind. Die Arten, die weniger stark betroffen sind aber den Pilz trotzdem tragen, können als Reservoir fungieren und den Pilz so weiterverbreiten. Es ist zudem auch möglich, dass Froschlurchen ebenfalls als Reservoir fungieren können. Einige Laboruntersuchungen aus diversen Studien wurden im „Bsal-Action-Plan“ der Europäischen Kommission publiziert. Die Resultate zeigen, dass besonders Populationen der Feuersalamander, Alpensalamander und Kammmolchen gefährdet sind. Weniger gefährdet sind Populationen der Teichmolche und Bergmolche. Der Fadenmolch ist von Bsal am wenigsten gefährdet und scheint resistent zu sein.
Es ist bekannt, dass post-metamorphe Amphibien, insbesondere Salamander anfällig sind. Die Larven der Feuersalamander sind allerdings nicht anfällig gegenüber Bsal (Van Rooi et al. 2015 [2]). Die larvale Anfälligkeit bei anderen Arten ist noch unbekannt.
Wachstumsbedinungen
Bsal wächst bei Temperaturen zwischen 5°C und 25°C, wobei die höchste Wachstumsrate zwischen 10°C und 15°C liegt (Martel et al. 2013 [3]). Es wurde jedoch gezeigt, dass natürliche Infektionen mit Bsal bei asiatischen Molchen der Gattung Tylototriton bei Wassertemperaturen von bis zu 26 °C auftreten. Diese hitzetolerantere Bsal Beobachtung deutet darauf hin, dass es wie bei Bd auch bei Bsal verschiedene Varianten gibt (Laking et al. 2017 [4] & Beukema et al. 2018 [5]).
Behandlung
Eine Wärmebehandlung kann alle Lebensstadien von Bsal abtöten. Alle Bsal-Kulturen wurden bei Feuersalamandern nach 10 Tagen Inkubation bei 25° C abgetötet (Vgl. Abbildung 7 / Bloii et al. 2015 [6]). Gemäss neueren Erkentnissen (Schulz et al. 2020 [7]) erweist sich allerdings die Inkubation bei 25°C erst ab 21 Tagen als effektiv. Bei einer zu kurzen Behandlungen blieb die Infektion erhalten und es kam nach 6 Wochen wieder zu Geschwürbildungen.

© Bloii et al. 2015 [6]
Es gibt auch bis zu 26°C hitzetolerante Bsal-Varianten (siehe den oberen Abschnitt „Wachstumsbedinungen“). Weitere Forschungen dazu fehlen leider. Es ist davon auszugehen, dass die Inkubationstemperatur von 25°C meistens ausreicht. Ansonsten kann auch eine höhere Temperatur gewählt werden. Die Heilungserfolg der Salamander und Molche lässt sich optisch beobachten.
Handelt es sich um hitzeempfindliche Amphibien muss die Behandlung mit Antimykotika erfolgen. In einer Studie (Bloii et al. 2015 [8]) wurden Bsal infizierte Feuersalamander geheilt. Die Feuersalamander hatten bei 20°C während 10 Tagen zwei Mal täglich ein Submersion Bad in Polymyxin E (2000 IU/ml, 10 Minuten) erhalten und wurden nach jedem Bad mit Voriconazol (12.5 μg/ml) besprayt. Bei Temperaturen von 15°C funktionierte diese Methode nicht.
Übertragung von Bsal
In der Wildnis kann Bsal durch aktive Träger (zum Bsp. Salamander, Molche, Froschlurchen) und passive Träger (zum Bsp. Vögel, Wasser, Schuhe, Geräte) verbreitet werden. Nicht alle Arten, die aktive Träger darstellen, also auf deren sich Bsal vermehrt, verenden oder erkranken an Bsal. Wäre Bsal für alle Wirte tödlich, würde die Infektionskette eher abbrechen.
In der Abbildung 8 sind mögliche Infektionsrouten dargestellt. In einer Studie (Stegen et al. 2017 [9]) konnte gezeigt werden, dass die Geburtshelferkröte und der Bergmolch Bsal als Reservoir dienen und die Infektion direkt oder via Wasser auf den Feuersalamander übertragen können (weiße Pfeile). Infizierte Feuersalmander können die Krankheit verbreiten, wenn sich Pilzsporen aus ihrem Körper ausbreiten (rote Pfeile). Die Authoren der Studie entdeckten eingekapselte Bsal Pilzsporen, die resistenter gegen die Prädation durch Zooplankton sind, als die bewegliche aquatische Form der Bsal Zoosporen (größere Prädation durch einen dickeren schwarzen Pfeil angezeigt). Die Vögel tragen als passive Träger ebenfalls zur Verbreitung der Bsal Sporen bei. Die auf der Wasseroberfläche treibenden eingekapselten Pilzsporen gibt es bei Bd nicht. Diese Dauersporen befähigen Bsal vermutlich auch im Waldboden monatelang überleben zu können.
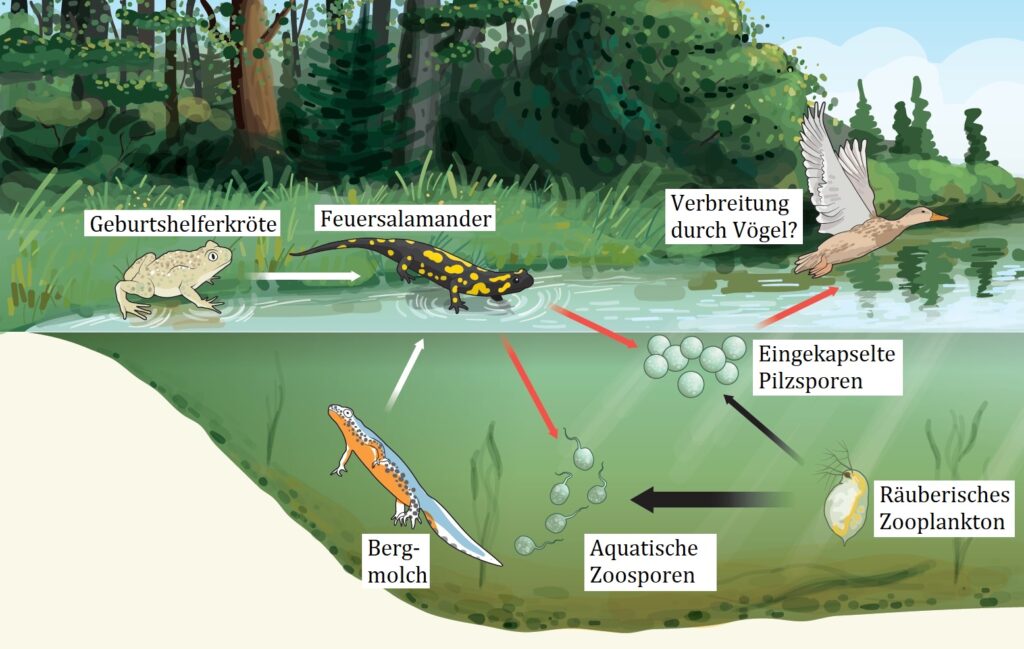
© Matthew Fisher / nature.com
Andere Wirte von Bsal: Flusskrebse, Fische, Wasserschnecken, Algen und Kaulquappen?
Der Chytridpilz Bd ernährt sich von dem Keratin der verhornten Hautanteilen der Amphibien. Die Kaulquappen haben vorerst keine verhornte Haut, sondern nur verhornte resp. keratinhaltige Mundpartien. So ernährt sich Bd bei den Kaulquappen nur vom Keratin der verhornten Mundpartien und erst später von den immer mehr verhornteren Hinterbeinen (McMahon et al. 2014 [10]). Keratin oder keratinähnliche Substanzen enthalten übrigens auch zahlreiche Wirbellose und Wirbeltiere in ihrem Magen-Darm-Trakt (Schaffeld et al. 2004 [11]). Bd vermehrt sich zum Bsp. im Gastrointestinaltrakt gewisser Flusskrebse ((Procambarus alleni, P. clarkii und Orconectes virilis) und kann dort mindestens 12 Wochen überleben. Die Forscher haben 10 nicht infizierte Kaulquappen des Südlichen Leopardfrosches (Lithobates sphenocephalus) im selben Behälter wie infizierte Flusskrebse gehalten und stellten fest, dass am Schluss der Chytridpilz Bd auf 7 von 10 der Kaulquappen-Münder gefunden werden konnte (McMahon et al. 2013 [12]). Auf dem Moskitofisch (Gambusia holbrooki) konnte bisher kein Bd nachgewiesen werden (McMahon et al. 2013 [12]). Ebenfalls kein Bd wurde bei den Süsswasserschnecken (Physella acuta) und bei den Algen der Gattung Cladophora nachgewiesen (McMahon et al. 2020 [13]).
Es gibt allerdings verschiedene Bd Varianten, die sich untereinander auch rekombinieren können und sich so rasch neue Eigenschaften aneignen können. Daher müssen solche Bd Studien mit Vorsicht begutachtet werden und wenn möglich mit anderen Bd Varianten wiederholt werden. Alle diese Experimente müssen auch mit Bsal gemacht werden. Es ist bisher nicht bekannt ob Bsal auch auf Flusskrebse oder anderen nicht-amphibischen Tiere als Reservoir zurückgreifen kann.
Eingeschränkte Fitness
Es ist davon auszugehen, dass auch ein nicht tödlicher Bsal Befall zu geringer Fitness führt und die betroffenen Amphibien dazu noch anfälliger für andere Parasiten macht. Allerdings gibt es hierzu im Fall von Bsal noch keine wissenschaftliche Untersuchungen. Beim länger bekannten Bd hingegen wurde beispielsweise festgestellt, dass Bd infizierte Kaulquappen der Erdkröten (Bufo bufo) überleben, aber nach der Metamorphose eine geringere Fitness (Größe und Sprungkraft) aufweisen (Brilha, 2014 [14]).
Betroffene Wälder nicht betretten
Es gibt aktuell keine Behandlungsmethode für die Salamander und Molche in der Natur. In naher und mittlerer Zukunft scheint es auch völlig unwahrscheinlich, dass Möglichkeiten gefunden werden großflächlich zu helfen. Die beste Methode ist daher aktuell die Verbreitung des Bsal möglichtst hinauszuzögern oder zu verhindern. Wichtig ist es dabei das Auftretten von Bsal, also zum Beispiel kranke oder toten Feuersalamander mit erkennbaren Symptomen vorzeitig zu melden. In den Niederlanden wurde in gewissen betroffenen Wäldern das Verlassen des Weges verboten, dazu wurden Plakate aufgehängt (vgl. Abbildung 9). Am feuchten Schuh kann der Bsal Pilz länger überleben und in andere Gebiete verschleppt werden. Die Plakate empfehlen zudem die Schuhe nach Begehung des betroffenen Gebietes während einer Woche trocknen zu lassen.

© sosvuursalamander.nl
Verbot von Import / Handel
Europäische Union, Schweiz und Grossbritannien
Es wird vermutet das Bsal via dem Tierhandel nach Europa gebracht wurde. Um eine weitere Verbreitung von Bsal via Tierhandel zu verhindern oder einzuschränken wurden Sonderbestimmungen für die Ein- und Ausfuhr von sämtlichen Amphibien der Ordnung der Schwanzlurche (Caudata) in die EU-Staaten, die Schweiz und Grossbritannien getroffen; für den Import wird nun eine amtliche Veterinärbescheinigung verlangt. Die EU hat dazu schon mehrere Durchführungsbeschlüsse herausgegeben, der aktuellste Durchführungsbeschluss für Bsal vom 22. Februar 2021 kann hier nachgelesen werden.
Nordamerika (USA, Kanada, Mexiko)
Die größte Diversität von Salamander und Molchen gibt es in Nordamerika insbesondere in den Vereinigten Staaten. Da diese Arten in Labortests ebenfalls anfällig auf Bsal reagiert haben, gilt es die Einfuhr von Bsal nach Nordamerika unbedingt zu verhindern. Der U.S. Fish and Wildlife Service verhängte deshalb im Januar 2016 ein Verbot für den Handel mit 201 Salamander und Molch Arten. Die spätere Entdeckung, dass auch Froschlurchen Bsal übertragen können, hat jedoch zu einem Aufschrei von Wissenschaftlern geführt, die die Regierung auffordern den Import aller Amphibienarten zu verbieten. Kanada hat im Mai 2017 Importbeschränkungen für alle Schwanzlurchen erlassen. Mexiko, mit der weltweit zweithöchsten Diversität an Salamandern, hat bis auf gewisse Risikoanalysen noch keine Schutzmassnahmen ergriffen.
Desinfektion
Wer auf Amphibien Tour geht sollte seine Materialien desinfizieren. In einer Studie (Van Rooij et al. 2017 [15]) wurden verschiedene Desinfektionsmittel gegen Bsal getestet. Es wird empfohlen 1 % Virkon S®, 4 % Natriumhypochlorit und 70 % Ethanol für die Desinfektion von Geräten im Feld, im Labor oder in Gefangenschaft, mit einer minimalen Kontaktzeit von 5 Minuten für 1 % Virkon S® und 1 Minute für die letztgenannten Desinfektionsmittel zu verwenden. Diese Bedingungen wirken nicht nur effizient gegen Bsal, sondern auch gegen Bd und den Ranavirus. Wasserstoffperoxid, sehr wirksam gegen Bd, eignet sich bei Bsal nicht als Desinfektionsmittel. PS. Wer sein Desinfektionsmittel nicht findet, kann mit kochendem Wasser desinfizieren.
Ist eine Desinfektion nicht möglich? Schwere landwirtschaftliche Maschinen (vgl. Abbildung 10 & 11) sollten vor dem Transport möglichst wenig Material enthalten. Es sollte so viel schlammiger Boden und Bewuchs von der Maschine wie möglich entfernt werden.


Nachweis von Bsal
Nachweis per DNA
Mit der Duplex Realtime-PCR Methode können Hautabstriche oder Hautproben gleichzeitig quantitativ auf Bsal und Bd getestet werden. Es ist die beste Methode. Die DNA Sequenzierung (Bestimmung der Buchstaben-Abfolge des gesamten Erbgutes) gibt selbstverständlich mehr Informationen auch über Abstammung und mögliche Bsal Varianten. Die DNA Sequenzierung ist allerdings aktuell noch viel zu teuer und zu zeitaufwendig.
Nachweis per Mikroskop
Es gibt noch keinen immunochemischen Nachweis per Mikroskop bei dem Bd von Bsal unterschieden werden kann. Die Unterscheidung mit Hilfe der mikroskopischen Histologie ist allerdings möglich. In Abbildung 12 wurde die Haut vom Grünlichen Wassermolch (Notophthalmus viridescens) verglichen. Die Chytridiomykose vom Bd (A) zeigt v. a. Chytrid-Vegetationskörper in oberflächlichen Keratinozyten. Deutlich zu sehen sind Keratinozyten mit intakten Zellkernen (N). Bei Bsal (B) dagegen dringen die Chytrid-Vegetationskörper tiefer in die Haut ein, fast die gesamte Dicke der Keratinozyten ist betroffen.
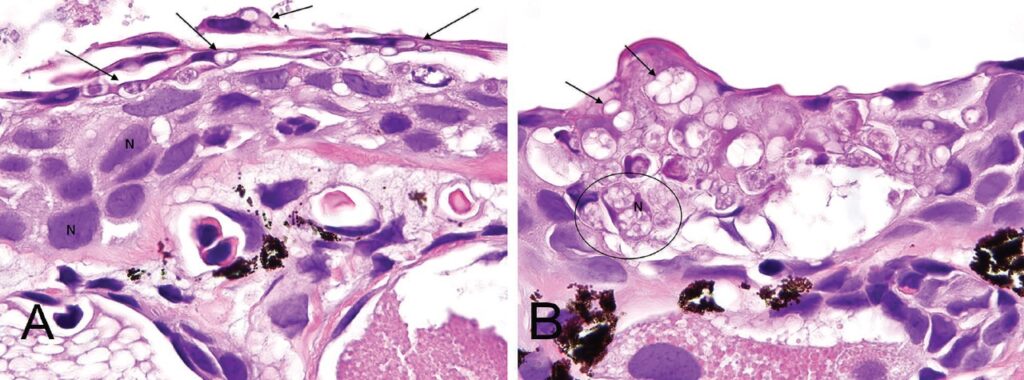
© C. White et al., 2016
Zukunft von Bsal in Europa
Gemäss Meinung zahlreicher Wissenschaftler wird Bsal sich leider weiterverbreiten. Die Bestände gewisser Arten, inbesondere der Feuersalamander, werden vermutlich vielerorts wie in den Niederlanden zusammenbrechen. Die Wissenschaft kann zwar die ablaufenden Prozesse immer besser verstehen aber Methoden zur Vernichtung von Bsal in der Natur werden kaum entdeckt werden können. Hypothese: Die Bekämpfung von Bsal in der Natur erfordert Techniken, die weitaus komplizierter und komplexer sind als logische Erfindungen wie Flugzeuge, Computer, Funksignale, etc.
Gentechnologie und Ethik
Unabhängig ob letztlich Amphibien der Natur genetisch modifiziert werden oder nicht, wäre eine genetische Erforschung, weshalb gewisse Arten völlig resistent oder resistenter gegenüber Bsal sind, wünschenswert. Im Sinne der Wissenschaft resp. Generhaltung macht es jedenfalls Sinn ein Gen oder ein paar Gene zu verändern um Millionen von Genen resp. Genvarianten zu erhalten. Ist es verwerflich die Feuersalamander in der Natur großflächig aussterben zu lassen oder sie mit evt. geringsten Veränderungen gegenüber Bsal immun zu machen? Die Nutzpflanzen wurden in der Vergangenheit völlig mit Radioaktivität verballert um neue Arten und Eigenschaften zu kreieren. Dagegen wären geringfügig und bekannte Veränderungen von DNA Sequenzen kaum nennenswert. Was keiner Ethik entspricht, ist die Verschleppung zahlreicher Lebewesen um den ganzen Planeten, der ganze Giftcocktail an Pesitizend und Medikamentenrückständen, der auf die Umwelt losgelassen wird und die völlige Zersiedlung und Zerstörung wertvoller Habitate.
Links
- Bsal Niederlanden
- Bsal USA
- Bsal Europa
- www.bsaleurope.com
- Fälle aus Europa melden
- www.bsaleurope.com/report-cases/ (inklusive Schweiz)
- Diagnostik Zentren für Bsal Tests in Europa
- Lehrvideos in Englisch
- Fälle aus Europa melden
- www.bsaleurope.com
- www.niklas-wildlife.com/batrachochyrium-salamadrivorans
- Bsal Projects
- Bochum
- University of Trier
- University of Gießen
- University of Leipzig
- Fundmeldesystem der Biologischen Station Mittlere Wupper (NRW)
- Bsal Projects
Quellenverzeichnis
[1] A. Martel, M. Blooi, C. Adriaensen, P. Van Rooi, W. Beukema, M. C. Fisher, R. A. Farrer, B. R. Schmidt, U. Tobler, K. Goka, K. R. Lips, C. Muletz, K. R. Zamudio, J. Bosch, S. Lötters, E. Wombwell, T. W. J. Garner, A. A. Cunningham, A. Spitzen-van der Sluijs, S. Salvidio, R. Ducatelle, K. Nishikawa, T. T. Nguyen, J. E. Kolby, I. Van Bocxlaer, F. Bossuyt, F. Pasmans, 2014: Recent introduction of a chytrid fungus endangers Western Palearctic salamanders. Science 346:630–631 link
[2] P. Van Rooi , A. Martel, F. Haesebrouck, F. Pasmans, 2015: Amphibian chytridiomycosis: a review with focus on fungus-host interactions. Veterinary Research 46, Article number: 137 link
[3] A. Martel, A. Spitzen-van der Sluijs, M. Blooi, W. Bert, R. Ducatelle, M. C. Fisher,
A. Woeltjes, W. Bosman, K. Chiers, F. Bossuyt, F. Pasmans, 2013: Batrachochytrium salamandrivorans sp. nov. causes lethal chytridiomycosis in amphibians. PNAS September 17, 2013 110 (38) 15325-15329 link
[4] A. E. Laking, H. N. Ngo, F. Pasmans, A. Martel, T. T. Nguyen, 2017: Batrachochytrium salamandrivorans is the predominant chytrid fungus in Vietnamese salamanders. Scientific Reports 7, 44443 (2017) link
[5] W. Beukema, A. Martel, T. T. Nguyen, K. Goka, D. S. Schmeller, Z. Yuan, A. E. Laking, T. Q. Nguyen, C. Lin, J. Shelton, A. Loyau, F. Pasmans, 2018: Environmental context and differences between native and invasive observed niches of Batrachochytrium salamandrivorans affect invasion risk assessments in the Western Palaearctic. Diversity and Distributions, Volume 24, Issue 12, 1788-1801 link
[6] M. Blooi, A. Marte, F. Haesebrouck, F. Vercammen, D. Bonte, F. Pasmans, 2015: Treatment of urodelans based on temperature dependent infection dynamics of Batrachochytrium salamandrivorans. Scientific Reports 5, 8037 link
[7] V. Schulz, A. Schulz, M. Klamke, K. Preissler, J. Sabino-Pinto, M. Müsken, M. Schlüpmann, L. Heldt, F. Kamprad, J. Enss, M. Schweinsberg, J. Virgo, H. Rau, M. Veith, S. Lötters, N. Wagner, S. Steinfartz, M. Vences, 2020: Batrachochytrium salamandrivorans in the ruhr district, germany: History, distribution, decline dynamics and disease symptoms of the salamander plague. SALAMANDRA 56(3): 189–214 link
[8] M. Blooi, F. Pasmans, L. Rouffaer, F. Haesebrouck, F. Vercammen, A. Martel, 2015: Successful treatment of Batrachochytrium salamandrivorans infections in salamanders requires synergy between voriconazole, polymyxin E and temperature. Scientific Reports 5, 11788 (2015) link
[9] G. Stegen, F. Pasmans, B. R. Schmidt, L. O. Rouffaer, S. Van Praet, M. Schaub, S. Canessa, A. Laudelout, T. Kinet, C. Adriaensen, F. Haesebrouck, W. Bert, F. Bossuyt, A. Martel, 2017: Drivers of salamander extirpation mediated by Batrachochytrium salamandrivorans. Nature 544: 353-356 link
[10] T. A. McMahon, J. R. Rohr, 2014: Transition of chytrid fungus infection from mouthparts to hind limbs during amphibian metamorphosis. Ecohealth. EcoHealth, Volume 12, 188–193 link
[11] M. Schaffeld, J. Markl, 2004: Fish keratins. Methods Cell Biol, 78:627–671 link
[12] T. A. McMahon , L. A. Brannelly, M. Chatfield, P. Johnson, M. Joseph, V. J. McKenzie, C. Zawacki, M. D. Venesky, J. R. Rohr, 2013: Chytrid fungus Batrachochytrium dendrobatidis has nonamphibian hosts and releases chemicals that cause pathology in the absence of infection. PNAS January 2, 2013 110 (1) 210-215 link
[13] T. A. McMahon, C. Nordheim, D. Propokiak, 2020: Freshwater snails and the green algae Cladophora are probably not hosts of Batrachochytrium dendrobatidis. Freshwater Biology, 66 (3) link
[14] P. M. Brilha Patrício, 2014: How does exposure to the fungus Batrachochytrium dendrobatidis affects the tadpoles of the common toad, Bufo bufo, under different stresses? Dissertação de Mestrado em Biologia da Conservação, Universidade de Lisboa link
[15] P. Van Rooij, F. Pasmans, Y. Coen, A. Martel, 2017: Efficacy of chemical disinfectants for the containment of the salamander chytrid fungus Batrachochytrium salamandrivorans. PLoS One. 2017 Oct 12;12(10):e0186269 link
