Fliegenmadenkrankheit / Myiasis
Die Myiasis oder Fliegenmadenkrankheit beschreibt den Befall von lebendigen Tieren mit Fliegenmaden. Am meisten wird die Krankheit durch Fliegen der Familien Calliphoridae, Sarcophagidae, Chloropidae und Muscidae ausgelöst. In der Regel sind offene Wunden aber auch Körperöffnungen betroffen. Abgestorbenes Gewebe und Verschmutzungen durch Kot oder Urin locken Fliegen besonders an. Die eingenisteten Maden dringen vorerst nicht zu tief ein, da sie die sauerstoffreichere Umgebung bevorzugen. Je tiefer das Loch ist, desto tiefer dringen die Maden ein. Die Myiasis bei Menschen und Nutztieren, insbesondere Schafe, ist eher in den Tropen als in den gemäßigten Zonen anzutreffen. Allgemein wird zwischen obligaten Parasiten und fakultativen Parasiten unterschieden. Die obligaten Parasiten wachsen in der Natur nur auf gesundem Gewebe lebender Wirte, während die fakultativen Parasiten normalerweise in Aas, Kott oder verrottendem Pflanzenmaterial vorkommen, also saprophag sind.
Calliphoridae: Lucilia bufonivora (Krötengoldfliege)
Lucilia ist eine Gattung von Schmeißfliegen (Calliphoridae), die hauptsächlich aus saprophagen und fakultativen Parasiten besteht. Als einzig obligater Parasit der Amphibien unter den Schmeißfliegen ist bisher nur Lucilia bufonivora (Krötengoldfliege oder Krötenfliege) bekannt. Diese Fliegenart ist der Wissenschaft nicht neu, sondern wurde bereits vor über 100 Jahren an Krötenkadavern beschrieben. Das Verbreitungsgebiet beinhaltet Europa, Nordamerika, Asien und auch Nordafrika. In Mitteleuropa insbesondere der Niederlande und in Teilen Deutschland (Nordrhein-Westfalen) wurde die Krötengoldfliege am meisten nachgewiesen. Allerdings gibt es zu wenig Nachweise, vieles über die Verbreitung und Häufigkeit ist daher unbekannt. Mit Abstand am meisten betroffen in Europa sind die Erdkröten, insbesondere die größeren Erdkrötenweibchen, seltenere Nachweise gibt es bei Kreuzkröte, Wechselkröte, Grasfrosch, Wasserfrosch-Komplex, Geburtshelferkröte. Sehr selten nachgewiesen wurde die Krötengoldfliege auf dem Laubfrosch und dem Feuersalamander.
Lebensweise
In den Sommermonaten legt das Weibchen der Krötengoldfliege bis zu über 100 Eier auf den Rücken von lebenden Amphibien (vgl. Abbildung 1).

© S. Swoboda
Die je nach Temperatur nach wenigen Stunden geschlüpften Maden kriechen zu den Nasenlöchern und dringen dort in den Kopf ein. Sie führen vorerst zur Ausweitung und Zerstörung der Nasenlöchern (vgl. Abbildung 2).

© R. Stawikowski
Im späteren Verlauf werden andere nahegelegene Organe zerstört, bis die Amphibie schließlich stirbt. Während die Krötengoldfliegen tagaktiv sind, sind die Erdkröten nachtaktiv. Es ist unbekannt wie die Krötengoldfliegen ihre Wirtstiere lokalisieren. Wissenschaftler vermuten eine geruchliche Ortung der Amphibien. Befallene Erdkröten sind auch im Frühstadium meist an asymmetrischen, leicht nässenden Nasenöffnungen und untypischem, tagaktiven Verhalten erkennbar. Eine Übersicht zum Krankheitsverlauf ist in Abbildung 3 gezeigt.
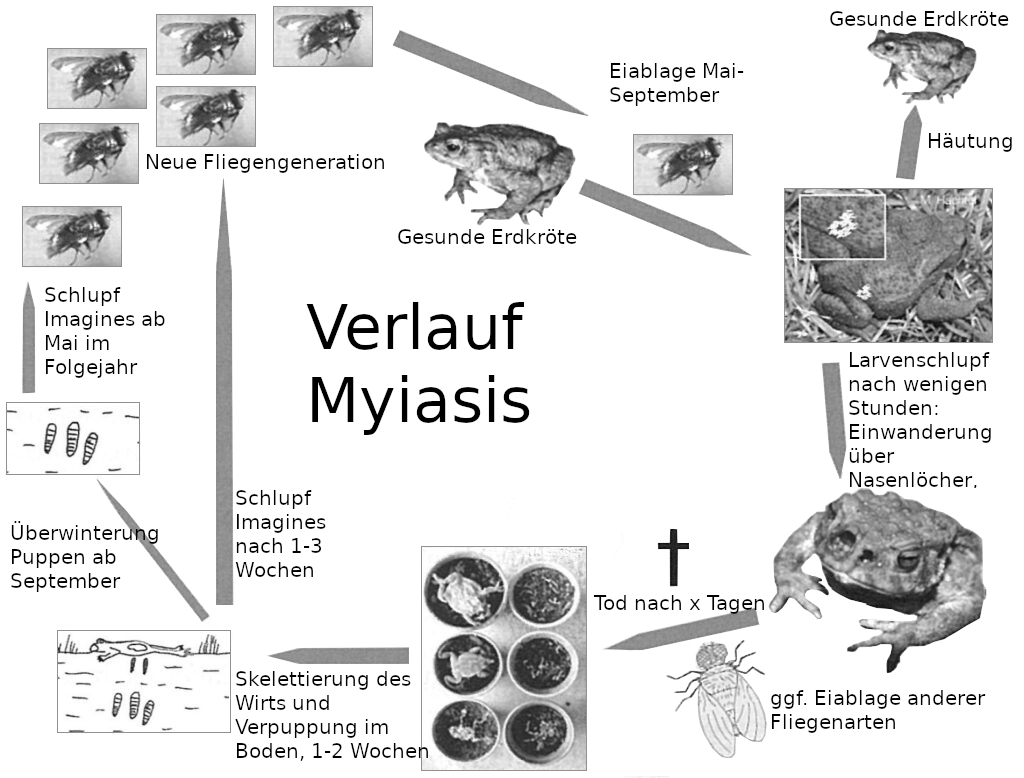
© B. Thiesmeier & K. Weddeling
[Download als .xcf Datei] [Download als .psd Datei] [Download Orginal als .jpg Datei]
Heilungserfolg
Der Befall endet für den Wirt normalerweise tödlich. Die Eier haften stark an der Amphibienhaut und gehen kaum verloren. Befreien kann sich die Kröte nur mit einer Häutung. Jüngere und schneller wachsende Kröten häuten sich öfters als ältere Exemplare. Da die Eier rasch Schlüpfen ist eine Befreiung durch Häutung selten oder eher unwahrscheinlich. Die Eier mit Pinsel zu entfernen misslangen, die Entfernung per Zahnbürste ist sehr mühsam und mit großem Aufwand verbunden. Die Entfernung mittels spitzer Pinzette ist allerdings möglich (Janzen 1994 [1]). Die Fliegeneier haften nicht an allen Amphibienarten so stark wie hier beschrieben. Bei einem Laubfrosch (Hyla arborea) waren die Eier leicht abstreifbar (Meisterhans et al. 1970 [2]). Sind die Maden bereits in die Nasenlöcher eingedrungen kann der Kröte nur noch geholfen werden, in dem alle Maden mit einer spitzen Pinzette entfernt werden. Dr. P. Janzen hatte einer Erdkröte 35 Maden aus Nase und Gaumenbereich entfernt. Nach 34 Tagen waren die Nasenlöcher zumindest äußerlich wieder verheilt (vgl. Abbildung 4).
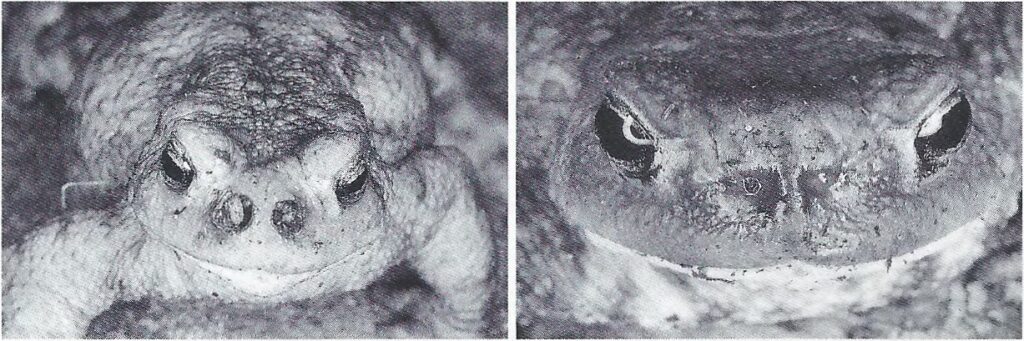
© P. Janzen
Die Maden mögen es nicht unter Wasser zu sein und können mit Hilfe des Wasser herausgelockt werden. Es ist anzunehmen, dass unter Wasser einige Maden dem Sauerstoffgradienten folgen und die Kröte von alleine verlassen (vlg. Abbildung 5). Zumindest wurde in Nordamerika bei Eisfröschen beobachtet, dass sich im Wasser badende Frösche von den Maden befreien konnten (Roberts 1998 [3]). Allerdings besiedelten dort die Maden wohl nicht die Nasenlöcher und konnten so vom Frosch länger unter Wasser gehalten werden.
Unheilbar kranke Kröten erlösen
Ist der Befall bereits zu weit fortgeschritten sollte das Tier von den Schmerzen erlöst werden. Eine in der Natur lebende Kröte ohne Geruchssinn am Leben zu halten ist zudem fragwürdig. Für das schmerzfreie Einschläfern der zu erlösenden Amphibien wird die Verwendung der verschreibungspflichtigen Substanz MS-222 und nicht die Methode „Cooling then Freezing“ (Shine et al. 2015 [4]) empfohlen (Frau dipl. med. vet. Petra Lohmann, persönliche Kommunikation 02. August 2021).

© Wikipedia User Jona23d
Weitere Variante von Lucilia bufonivora mit anderem Myisasis Muster
In Nordamerika aber auch in Eurasien wurde eine weitere Variante von L. bufonivora ursprünglich ständig als L. silvarum (Waldgoldfliege) bezeichnet. L. bufonivora und L. silvarum ähneln sich vom Phänotyp und der Verbreitung her stark und sind genetisch nur anhand der richtig ausgewählten DNA Fragmente oder einer kompletten Sequenzierung zu unterscheiden. So wurden ungünstige DNA-Fragmente verglichen und die zweite Variante von L. bufonivora lange Zeit mit L. silvarum verwechselt. Die zweite Variante von L. bufonivora ist hauptsächlich saprophag, selten aber auch als fakultativer Parasit von Amphibien bekannt. Die Eier werden wie bei der herkömmlichen L. bufonivora auf den Rücken der Amphibien gelegt. Wobei die geschlüpften Maden der zweiten Variante nicht zu den Nasenlöchern wandern sondern direkt durch die Haut versuchen einzudringen. Unter der Haut wandern die Larven zum Teil weiter um sich an einer einizgen Stelle zu versammeln. Später geschlüpfte Maden kriechen zum bereits nekrotischen Geweben und dringen dort ein. Das nekrotische Gewebe zieht durch den Geruch weitere Fliegen an.
L. silvarum gilt damit seit zumindest im untersuchten Gebiet der nördlichen Erdhalbkugel als kein fakultativer Parasit mehr von Amphibien, sondern wird als strikt saprophag betrachtet. Allerdings ist noch nicht untersucht ob die zweite Variante von L. bufonivora aus Nordamerika auch in Eurasien vorhanden ist, oder ob es sich dort um eine dritte Variante von L. bufonivora handelt (Whitworth et al. 2020 [5] & Whitworth, persönliche Kommunikation 09. August 2021).
Weitere fakultative Parasiten der Gattung Lucilia
Lucilia elongata wurde dreimal fälschlicherweise als fakultativer Parasit von Amphibien bestätigt, allerdings wurde bei diesen Nachweisen falsche Gene verglichen. Da L. elongata genetisch und morphologisch sehr ähnlich wie L. bufonivora ist, wird diese Art aber weiterhin als fakultativer Parasit von Amphibien in Nordamerika vermutet (Whitworth, persönliche Kommunikation 09. August 2021).
Lucilia thatuna ist wegen ihrer Verbreitung in den Sumpfgebieten interessant. Ein direkter Nachweis auf Amphibien gibt es bei L. thatuna allerdings bisher nicht.
Lucilia ampullacea wurde auf einer Erdkröte in München nachgewiesen (Glaw et al. 2014 [6]). Die Maden dringen bei L. ampullacea wie bei allen fakultativen Parasiten über die Haut und nicht via den Nasenlöchern ein.
Nachweis durch sekundären Befall erschwert
Eine an der herkömmlichen L. bufonivora erkrankte Kröte wird im späteren Krankheitsverlauf desöfteren sekundär auch von fakultativen Parasiten befallen. Die Fliegenmaden bevorzugen in der Regel die Verpuppung letztlich im Boden und nicht in den Amphibien selber. Somit sollte bei einer Probe immer auch der Boden unterhalb der toten Amphibie auf Madenpuppen geprüft werden.
Myiasis in Süd- und Mittelamerika
Sarcophagidae: Lepidodexia sp.
In der neotropischen Region (Süd- und Mittelamerika) sind besonders die Fleischfliegen (Sarcophagidae) der Gattung Lepidodexia für Myiasis bei Amphibien verantwortlich. Wobei es von Lepidodexia bufonivora am meisten Nachweise gibt. Weitere Lepidodexia Arten, die an Amphibien nachgewiesen wurden, sind Lepidodexia centenaria und die neue beschriebene Art Lepidodexia adelina. Manchmal wurde auch nur die Gattung Lepidodexia oder sogar nur die Familie Sarcophagidae bestimmt. Es existieren zudem noch über hundert weitere Arten der Gattung Lepidodexia. Das sehr warme feuchte Klima, und dadurch verbunden das schnelle Wachstum der Maden und die beschleunigte Verwesung, wie auch die oftmals sehr geringe Größe der Amphibien, erschwerren die Nachweise weiterer Lepidodexia sp. massiv.
Das untere Video (vgl. Video 1) zeigt eine Lepidodexia sp., die einen tagsüber ruhenden und exponierten Laubfrosch (Hylidae) der Art Bokermannohyla hylax attackiert. Es ist sehr wahrscheinlich das einzige Video, das eine Fliege bei der Ei- oder Madenablage auf einer lebenden Lurche zeigt. Das Schicksal des Frosches ist unbekannt, weder Made noch Frosch wurden eingesammelt, daher gibt es nur einen Nachweis der Gattung Lepidodexia. Bei Bokermannohyla caramaschii und Bokermannohyla luctuosa gibt es ebenfalls nur den Nachweis von Lepidodexia sp. Es wurden zwar Maden eingesammelt, diese allerdings sofort in 70% Ethanol getötet. Das sofortige töten der Maden ist ein Fehler, den per Mikroskop oder hochauflösender Kamera sind die fertigentwickelten Fliegen im Gegensatz zu den Maden viel eher für den Entomologen unterscheidbar. In einem anderen Fall wurden in Pristimantis thectopternus gefundene Maden ebenfalls sofort in 70 % Ethanol getötet. Dort konnten die Entomologen gar nur noch die Familie Sarcophagidae nachweisen. Im schlimmsten Fall kann nicht einmal eine Familie zugeordnet werden. Ohne jegliche Anhaltspunkte benötigt es für den Nachweis evt. sogar eine vollständige DNA Sequenzierung, die zu teuer ist. Nach einer groben Zuordnung durch einen Entomolgen kann eher mit spezifischen Primern gearbeitet werden. Es muss also nichts sequenziert werden, sondern nur ermittelt werden ob der Primer an die DNA bindet, wie beim PCR Corona-Test.
© Rafael Guadeluppe
- Nachweise von nicht identifizierter Fliege
- Nachweise von Sarcophagidae
- Centrolenidae: Hyalinobatrachium fleischmanni (Medina et al. 2009 [8])
- Hylidae: Boana atlantica (Oliveira et al.2012 [9]), Scinax fuscovarius and Scinax ruber (Souza-Pinto et al. 2015 [10]), Dryaderces inframaculata (Pinto et al. 2017 [11]), Dendropsophus schubarti in Peru (Junes et al. 2019 [12])
- Strabomantidae: Pristimantis thectopternus (Gómez-Hoyos et al. 2012 [13])
- Bufonidae: Rhinella diptycha (Souza-Pinto et al. 2015 [10]), Rhinella alata (Kelehear et al. 2020 [14])
- Leptodactylidae: Leptodactylus latrans (Müller et al. 2015 [15]).
- Nachweise von Lepidodexia sp.
- Hylidae: Bokermannohyla hylax, Bokermannohyla caramaschii und Bokermannohyla luctuosa (Lemos et al 2019 [16])
- Nachweise von Lepidodexia bufonivora
- Nachweis von Lepidodexia centenaria
- Hylidae: Hypsiboas beckeri in Brasilien (Mello-Patiu et al. 2010 [20]). L. centenaria ist offenbar wirtsspezifisch für H. beckeri und einheimisch in hochgelegenen Regionen des brasilianischen atlantischen Regenwaldes, im Gegensatz zu dem Habitat- und Wirtsgeneralisten Lepidodexia bufonivora (Mello-Patiu et al. 2010 [20]).
- Nachweis von Lepidodexia adelina
- Leptodactylidae: Adenomera diptyx, Leptodactylus elenae und Physalaemus albonotatus alle drei wurden in Argentinien gefunden und haben eine neue Lepidodexia Art beschrieben (Mulieri et al. 2018 [21]).
Sarcophagidae: Peckia (Sarcodexia) lambens
Peckia (Sarcodexia) lambens gehört ebenfalls zur Familie Sarcophagidae. P. lambens ist weitverbreitet und gehört zu den wichtigesten forensischen Fleischfliegen zur Ermittlung der Leichenliegezeit in Süd- und Mittelamerika. P. lambens ist ein Parasit der Schmetterlingsraupe von Spodoptera frugiperda (Herbst-Heerwurm), einem Schädling von Mais Monokulturen. S. frugiperda ist in zahlreichen Ländern Afrikas und in Indien und China eingeschleppt worden, vorstellbar dass auch P. lambens unabsichtlich oder absichtlich in andere Gebiete gelangen könnte.
- Nachweis von Peckia (Sarcodexia) lambens
- Dendrobatidae: Ameerega cainarachi und Ameerega trivitatta in der San Martín Region von Peru (Hagman et al. 2005 [22])
Phoridae: Megaselia scalaris
Neben der Familie der Fleischfliegen ist auch die Art Megaselia scalaris, der Familie der Buckelfliegen (Phoridae), für Myiasis bei Amphibien in Südamerika bekannt. M. scalaris wird bis 2-3 mm lang und kann sich durch den Boden bis zum Sarg graben, was ihr den Spitznamen „coffin fly“ zu Deutsch „Sargfliege“ gab. M. scalaris ist in der Forensik sehr wichtig und oftmals sogar das einzige forensische Beweismittel, das zur Verfügung steht, wenn die Leiche verdeckt oder an einer Stelle versteckt ist, die für andere Insekten schwer zu erreichen ist. Desweiteren wird M. scalaris häufig in der Forschung und im Labor verwendet, da sie leicht zu kultivieren ist. Die Nachweise (siehe unten) von M. scalaris bei Amphibien sind bisher selten. Von Boana faber wurden allerdings gleich drei betroffene Exemplare gefunden, zwei davon sind unten abgebildet (vlg. Abbildung 6).
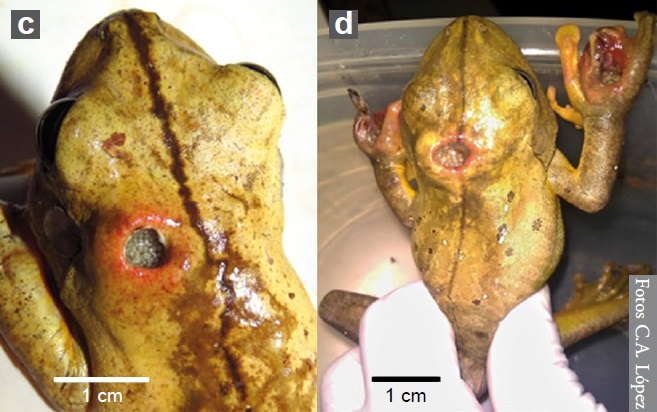
© C. A. López
- Nachweise von Phoridae: Megaselia scalaris
Myiasis in Australien
In Australien sind mindestens 10 Arten der Gattung Batrachomyia (Australische Froschfliegen) der Familie Halmfliegen (Chloropidae) für den Befall von Fröschen der Familien Hylidae und Myobatrachidae bekannt. Die Eier der Batrachomyia sp. benötigen hohe Feuchtigkeit und werden nahe der Frösche platziert. Wenn eine Made einen Frosch erreicht versucht sie sich dort einzunisten und wächst im Frosch zu einer Länge von bis zu 10 mm heran. Da ein Frosch in der Regel nur von einer oder wenigen Maden (≤ 4) befallen wird, überleben bis zu 90% der Frösche (Mullen et al. 2009 [25]). Am meisten Nachweise gibt es bei der Gattung Litoria, der artenreichsten Gattung der Australischen Laubfrösche. In der unteren Abbildung 7 ist ein infiziertes Exemplar von Litoria genimaculata gezeigt.
In Papua-Neuguinea einem Inselstaat neben Australien wurde ebenfalls eine Australische Froschfliege entdeckt. Die Art nennt sich Batrachomyia krausi und kommt in Australien selber nicht vor oder wurde dort noch nicht nachgewiesen. B. krausi wurde als Parasit des Frosches Papurana supragrisea der Familie Ranidae nachgewiesen. Es ist der erste Nachweis für den Befall von Fröschen der Familie Ranidae durch Batrachomyia (Evenhuis 2006 [26]).

© Jean-Marc Hero
Fazit
Die Myiasis in Amphibien ist zwar ein ekliges Phänomen, aber Bedrohungen für die Existenz gewisser Amphibienarten wurden bisher noch keine nachgewiesen. Generell für Mensch und Tier ist wichtig Wunden richtig zu behandeln und eine gewisse Hygiene zu beachten, insbesondere in den tropischen Gebieten. In seltenen Fällen können auch Stubenfliegen (Musca domestica) zum Problem werden. Zum Bsp. bei einer Persischen Trughornviper wurde eine durch Musca domestica verursachte Wundmyiasis festgestellt (Dehghani et al. 2012 [27]).
Myiasis verursachende Fliegen schaden auch unseren Nutztieren, insbesondere den sehr anfälligen Schafen. Das Schaffleisch ist ja bekanntlich immer wieder von Maden durchsetzt. Eine Ausrottung von Myiasis spezialisierten Fliegen sollte daher in Betracht gezogen werden.
Quellenverzeichnis
[1] P. Janzen, 1994: Heilungserfolg bei Erdkröten (Bufo bufo) mit Lucilia-Befall (Diptera: Calliphoridae). Salamandra Vol 30: 265–267 link
[2] Meisterhans, K. & H. Heusser, 1970: Lucilia-Befall an vier Anuren-Arten. Mitteilungen der Schweizerischen Entomologischen Gesellschaft 43(1): 41-44
[3] W. R. Ropberts, 1998: The calliphorid fly (Bufolucilia sylvarum) parasitic on frogs in Alberta. Alberta Naturalist 28: 48.
[4] R. Shine, J. Amiel, A. J. Munn, M. Stewart, A. L. Vyssotski, J. A. Lesku, 2015: Is “cooling then freezing” a humane way to kill amphibians and reptiles? Biol Open 15 July 2015; 4 (7): 760–763 link
[5] T. L. Whitworth, M. G. Bolek, G. Arias-Robledo, 2021: Lucilia bufonivora, Not Lucilia silvarum (Diptera: Calliphoridae), Causes Myiasis in Anurans in North America With Notes About Lucilia elongata and Lucilia thatuna. Journal of Medical Entomology, Volume 58, Issue 1, January 2021, Pages 88–92 link
[6] F. Glaw, J. Moriniere, D. Doczkal, 2014: Myiasis of the common toad (Bufo bufo) caused by the blowfly Lucilia ampullacea. Zeitschrift fur Feldherpetologie 21(1):83-95 link
[7] R. von May, E. Biggi, H. Cárdenas, M. I. Diaz, C. Alarcón, V. Herrera, R. Santa-Cruz, F. Tomasinelli, E. P. Westeen, C. M. Sánchez-Paredes, J. G. Larson, P. O. Title, M. R. Grundler, M. C. Grundler, A. R. Davis Rabosky, D. L. Rabosky, 2019: Ecological interactions between arthropods and small vertebrates in a lowland Amazon rainforest. Amphibian & Reptile Conservation 13:65–77 link
[8] D. Medina, M. Rivera, R. Cossio, E. Medina, S. Bermúdez, 2009: Primer registro de miasis por Sarcophagidae (Diptera: Oestroidea) en Hyalinobatrachium fleischmanni (Anura: Centrolenidae) de Panamá. Revista Mexicana de Biodiversidad 80:263–264 link
[9] R. M. de Oliveira, C. V. de Mira Mendes, D. S. Ruas, M. Solé, L. C. Pinho, R. Rebouças, 2012: Myiasis on Hypsiboas atlanticus (Caramaschi and Velosa, 1996) (Anura:Hylidae) from southern Bahia, Brazil. Herpetology Notes 5:493–494 link
[10] F. C. de Souza-Pinto, I. F. França, C. A. de Mello-Patiu, 2015: Brief description of myiasis cases in three amphibian species from Atlantic Forest located in the central region of the State of Minas Gerais, Brazil. Herpetology Notes, volume 8: 287-290 link
[11] K. C. Pinto, B. C. Padilha, L. S. dos Santos Cruz, G. de Avila Batista, M. D. Pinto Rossi, D. L. Martins, M. P., W. Vaz-Silva, J. M. Neves, 2017: Myiasis caused by Sarcophagidae fly in Dryaderces inframaculata (Boulenger, 1882) (Anura: Hylidae) in the north of Mato Grosso, Brazil. Herpetology Notes, volume 10: 147-149 link
[12] K. Junes, J. Ruiz, E. Quispitupac, 2019: Flesh-fy myiasis (Diptera: Sarcophagidae) in Dendropsophus schubarti (Anura: Hylidae) from Peru. Phyllomedusa: Journal of Herpetology, 18(2), 277-281 link
[13] D. A. Gómez-Hoyos, T. Suárez-Joaqui, O. H. Marín-Gómez, 2012: Flesh fly myiasis (Diptera: Sarcophagidae) in
Pristimantis thectopternus (Anura: Strabomantidae) from Colombia. Herpetology Notes, Volume 5: 27-29 link
[14] C. Kelehear, R. Ibáñez, C. Rodríguez, S. Buitrago, A. A. Durant-Archibold, 2020: Sarcophagid Myiasis in the Bufonid Rhinella alata in Panama. Journal of Wildlife Diseases 56(3), 667-672 link
[15] G. A. Müller, C. R. Lehn, A. Bemvenuti, C. B. Marcondes, 2015: First report of myiasis (Diptera: Sarcophagidae) in anuran of Leptodactylidae (Amphibia). Revista Colombiana de Ciencias Animales. 7. 217-220 link
[16] G. F. Lemos, L. R. Malagoli, R. Lourenço-de-Moraes, Myiasis in three species of Bokermannohyla (Hylidae, Anura). The Herpetological Bulletin 150, 2019: 37-38 link
[17] M. L. Crump, J. A. Pounds, 1985: Lethal parasitism of an aposematic anuran (Atelopus varius) by Notochaeta bufonivora (Diptera:Sarcophagidae). Journal of Parasitology 71:588–591 link
[18] R. Eizemberg, L. T. Sabagh, R. S. Mello, 2008: First record of myiasis in Aplastodiscus arildae (Anura:Hylidae) by Notochaeta bufonivora (Diptera:Sarcophagidae) in the Neotropical area. Parasitology Research 102:329–331 link
[19] F. G. Vázquez-Corzas, A. Sandoval-Comte, P. Hernández-López, S. Ibáñez-Bernal, E. Pineda, 2018: First records of parasitoidism by Sarcophagidae flies (Diptera) on three amphibian species in Mexico. Journal of Natural History 52(35-36):2339-2350 link
[20] C. A. de Mello-Patiu, C. de Luna-Dias, 2010: Myiasis in the Neotropical Amphibian Hypsiboas beckeri (Anura: Hylidae) by a New Species of Lepidodexia (Diptera: Sarcophagidae). Journal of Parasitology 96:685–688 link
[21] P. R. Mulieri, E. F. Schaefer, M. I. Duré, C. E. González, 2018: A new flesh fly species (Diptera: Sarcophagidae) parasitic on leptodactylid frogs. Parasitol Res 117, 809–818 link
[22] M. Hagman, T. Pape, R. Schulte, 2005: Flesh fly myiasis (Diptera, Sarcophagidae) in Peruvian poison frogs genus Epipedobates (Anura, Dendrobatidae). Phyllomedusa 4:69–73 link
[23] C. A. López, T. P. Lavinscky Pereira, M. G. Antúnez, M. E. Peichoto, 2016: Myiasis in the Neotropical amphibian Hypsiboas caingua (Anura: Hylidae) by Megaselia scalaris (Diptera: Phoridae). The Herpetological Bulletin, 38, 2016: 18-20 link
[24] C. A. López, 2019: Miasis por Megaselia scalaris en dos especies de anuros de la Selva Atlántica, provincia de Misiones (Argentina). Boletín de la Asociación Herpetológica Española (2019) 30(2) link
[25] G. R. Mullen, L. A. Durden, 2009: Medical and Veterinary Entomology link
[26] N. Evenhuis, 2006: First record of the frog parasite genus Batrachomyia Krefft from New Guinea (Diptera: Chloropidae). Zootaxa, 1351(1), 53–59. link
[27] R. Dehghani, M. Sedaghat, M. S. Bidgoli, 2012: Wound Myiasis due to Musca domestica (Diptera: Muscidae) in Persian Horned Viper, Pseudocerastes persicus (Squamata: Viperidae). J Arthropod Borne Dis. 2012;6(1):86-9 link
